该成果以“Directed evolution engineering to improve activity of glucose dehydrogenase by increasing pocket hydrophobicity”为题发表于Frontiers in Microbiology杂志(IF:6.064)

Introduction
氧化还原酶由于其高度的选择性特异性、催化活性和可持续发展,越来越多地被用作催化氧化还原反应的有力工具,这通常用于高价值药物和聚合物材料的生产。葡萄糖脱氢酶是一种氧化还原酶,是食品和制药工业中的一种重要酶,可用于葡萄糖测定试剂盒、葡萄糖生物传感器、辅因子再生、生物电极和生物燃料电池。它的正常活性蛋白是四聚体,存在于许多微生物和动物的肝脏中。目前,已从几种芽孢杆菌中分离出多种NAD(P)(+)依赖性GDH,包括解淀粉芽孢杆菌、巨大芽孢杆菌、枯草芽孢杆菌和苏云金芽孢杆菌。值得注意的是,这些来自芽孢杆菌的GDH通过氨基酸序列比对具有超过80%的同源性,它们在整体折叠和亚基结构上与其他短链脱氢酶相似。在以往的研究中,GDH的热稳定性是研究的重点。先前的研究发现,GDH可以催化NAD(+)或NADP(+),而NADP(+)的Kcat/Km值大约是NAD(+)的4倍。
在这项研究中,我们通过(1)通过AlphaFold2和Discovery Studio 3.0分析GDH突变体与NADP(+)之间的相互作用,(2)在大肠杆菌表达系统中使用pET-28a(+)比较葡萄糖脱氢酶突变体的生物活性,(3)使用8-苯胺-1-萘磺酸(ANS)荧光探针、SDS结合法和姜黄素对GDH突变体进行疏水性分析,(4)通过Ni(2+)亲和层析纯化的GDH突变体的表征,以及(5)分析有机溶剂影响的GDH突变株的催化活性和稳定性。该研究为生物分析、生物工业和生物能源领域的GDH研究提供了良好的基础。
Results and Discussion
1.GDH突变体与NADP(+)相互作用的分析
在本研究中,我们探讨了GDH突变体与配体NADP(+)之间的结合,因为其亲和力高于NAD(+)。最重要的是,八个GDH突变体的结构预测是由AlphaFold2提供的,它被用作对接的受体。以来自Burkholderia cenocepacia的NADP(+)为底物的葡萄糖脱氢酶(PDB:7V0H)作为模板。随后,Discovery Studio 3.0被用于分析GDH突变体和NADP(+)之间的蛋白质-配体相互作用(图1)。我们发现,GDH-NADP(+)配合物中Lys42的氨基和配体NADP(+)的羟基氧之间形成了1.7Å氢键(图1A)。在P45A-NADP(+)复合物中,还有五个氢键(1.9-2.5Å)与配体NADP(+)的磷酸基团形成。这可能是由于磷酸基团的位置影响氢键的形成(图1B)。其中,Tyr39的氨基和NADP(+)的甲基氧之间形成1.9Å氢键。值得注意的是,P45A中Ser40的氨基可以同时与NADP(+)的O-15(2.5Å)和O-16(2.1Å)形成两个氢键。此外,Ser40的羟基还与NADP(+)的O-16形成氢键(2.3Å)。同时,发现与野生GDH相比,Lys42被Ans41取代,后者可以与NADP(+)的O-15形成氢键。这一结果表明P45A对NADP(+)的亲和力可能高于野生型GDH。类似的氨基酸残基出现在P45A-NADP(+)复合物和Q252L-NADP(+)复合体之间,如Ser17、Tyr39和Ser40(图1C)。在F155Y-NADP(+)复合物中,Gln43的氨基可以与O-39(2.1Å)和O-40(2.5Å)形成2个氢键,这与野生型GDH不同(图1D)。在其他四个突变体中,Ser17、Leu19、Tyr39、Gln43、Gly20、Asn92和Ile195可以形成不同类型的氢键(图1E-H)。对接结果表明,这些突变体具有高催化效率的潜力。随后,使用定点诱变进一步评估其催化能力。
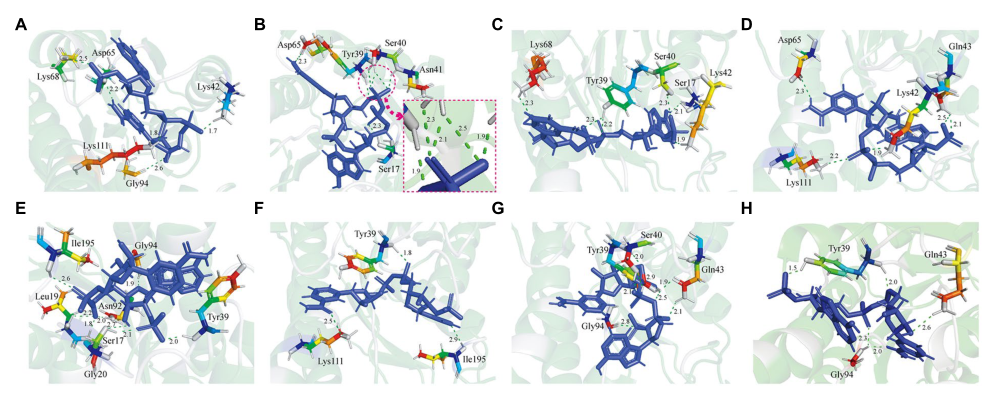
Figure 1 Analysis of the interaction between GDH mutants and NADP(+). (A) GDH-NADP(+)complex. (B) P45A-NADP(+)complex. (C) Q252L-NADP(+)complex. (D) F155Y-NADP(+)complex. (E) W230F-NADP(+)complex. (F) N46E-NADP(+)complex. (G) V227A-NADP(+)complex. (H) E170R-NADP(+)complex. The protein-ligand interactions between GDH mutants and NADP(+)were studied using Discovery Studio 3.0. The green dashed line represents the hydrogen bonds. The unit of bond length is angstrom (Å).
2. 葡萄糖脱氢酶突变体的生物活性比较
在本研究中,通过定点诱变构建了11个GDH突变体。将pET-28a(+)质粒、野生型GDH和单点突变(pET-GDH、pET-P45A、pET-N46E、pET-F155Y、pET-E170R、pET-V227A、pET-W230F和pET-Q252L)分别转化到大肠杆菌Bl-21中。SDS-PAGE结果表明,GDH突变体在大肠杆菌BL-21中得到了可溶性表达。我们通过分析340nm处NADPH的生成来检测单个变体的活性。比较所有七个选定残基的单个突变体的结果,我们发现P45A、F155Y和Q252L的催化活性与野生型相比显著增加,尤其是P45A,其酶活性提高了约29倍,达到1829 U/mg(图2B)。尽管N46E、E170R、V227A和W230F可以导致热稳定性至少提高50%,但四个单一突变体的酶活性没有变化。为了进一步提高GDH的催化能力,对P45A、F155Y和Q252L进行了组合和进一步分析。然而,突变P45A的影响主导了其他个体替代的影响。活性的增加顺序如下:P45A/F155Y/Q252L<P45A/F115Y<P45A/Q252L<P45A。在本研究中,用不同NADP(+)浓度检测NADPH生成的初始速率,以分析GDH突变体的动力学参数。我们发现突变体P45A的Km值显著低于其他突变体,而Kcat/Km值至少高出7倍(表1)。我们推测,这可能部分是由于P45A与NADP(+)形成氢键含量较高。P45A-NADP(+)复合物中有七个氢键,包括Asp65、Tyr39、Ans41和Ser17与NADP(+)的H-50、O-13、O-15和O-20形成的四个氢键(2.3Å、1.9Å、1.9Å和2.3Å),以及Ser40与NADP(+)O-15和O-16形成的三个氢键(2.5Å、2.1Å和2.3Å)。根据上述结果,我们推测残基Ser40在GDH的催化活性和NADP(+)结合能力中起着关键作用,如图1A-D所示。
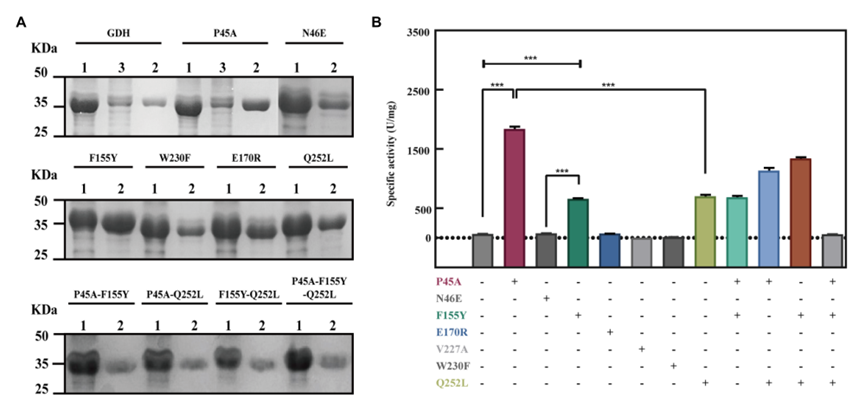
Figure 2 Improvement of the GDH catalytic ability by site-directed mutagenesis. (A) SDS polyacrylamide gel electrophoresis (SDS-PAGE) analysis of GDH mutants. Lane 1: crude enzyme solution; Lane 2: pure GDH mutants by Ni-NTA chromatography; Lane 3 flow-through of sample. 10 μg protein was analyzed by SDS-PAGE using 12% polyacrylamide gel. Protein bands were stained by Coomassie Brilliant Blue R250. (B) Evaluation of the mutants by site-directed mutagenesis. The results are expressed as the mean ±SD (n=3). * indicates p <0.05, ** indicates p<0.01, and *** indicates p<0.001.
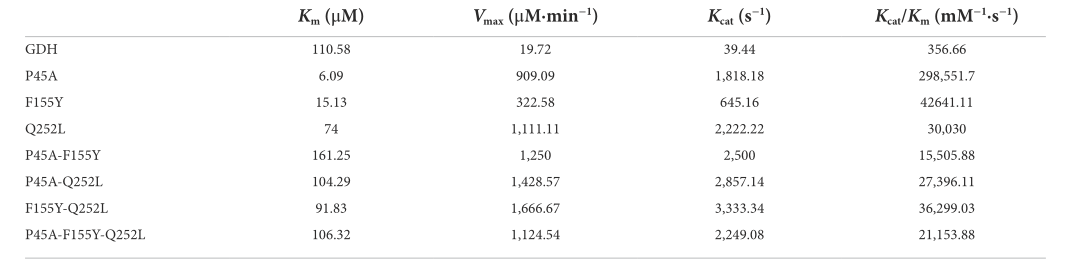
Table 1 Kinetic parameters of GDH mutants.
3. GDH突变体的疏水性分析
先前的研究我们推测GDH活性也可能与蛋白质疏水性有关。为了验证我们的假设,本研究选择了三个最重要的突变(P45A、F155Y和N46E)。首先,我们预测了蛋白质配体复合物的疏水性,并发现与野生型GDH相比,三种突变体的口袋疏水性发生了显著变化(图3)。值得注意的是,P45A-NADP(+)复合物的口袋疏水性增强(图3A,B),这与我们先前的推测一致。随后,使用ANS荧光探针检测蛋白质的疏水性,这可以在与蛋白质的疏水区域结合后显著增加荧光量子产率。分析GDH变体的荧光强度(λex 390 nm和λem 504 nm),并线性拟合(图4A)。曲线斜率用作蛋白质疏水性的指数。GDH、P45A、F155Y和N46E的疏水性指数分别为5674、8091、7708和5830(图4B)。同时,SDS结合法和姜黄素也用于检测蛋白质的疏水性。结果进一步表明,P45A的疏水性比其他GDH突变体更强,这与我们先前的发现一致。这表明GDH的酶活性与其口袋疏水性呈正相关(图2B、4B)。
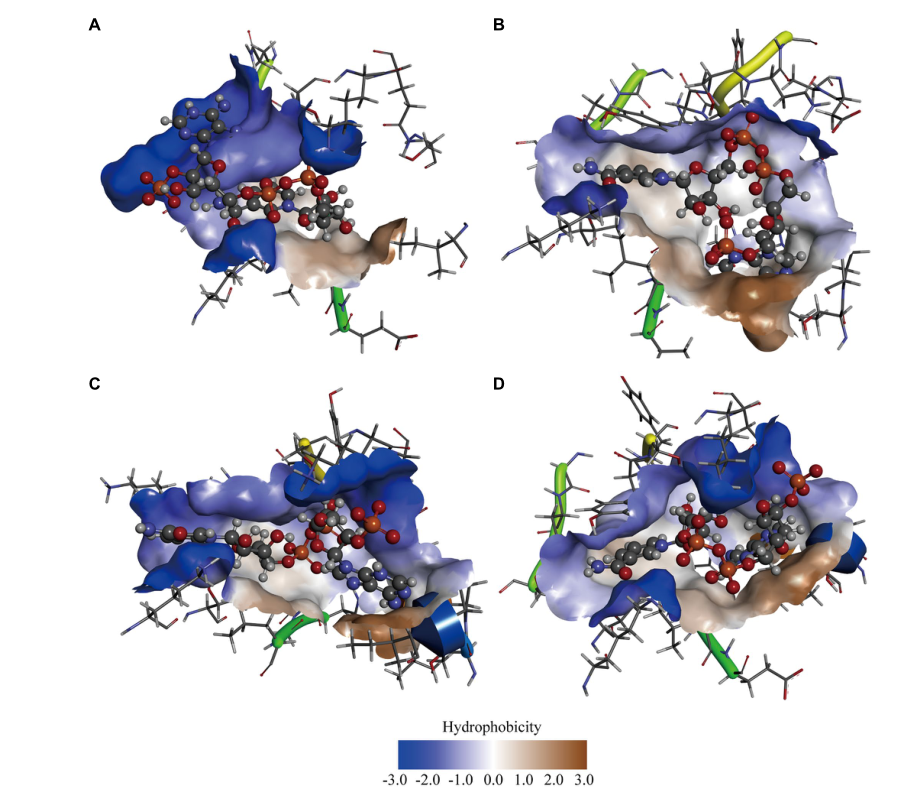
Figure 3 Computer-assisted hydrophobicity analysis of GDH mutants. (A) GDH-NADP(+)complex; (B) P45A-NADP(+)complex; (C) N46E-NADP(+)complex; (D) F155Y-NADP(+)complex. The shade of color indicates the strength of hydrophobicity.
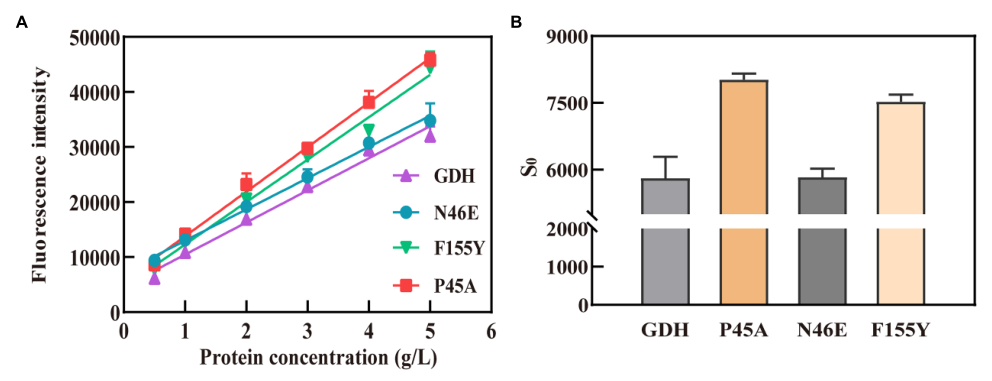
Figure 4 Hydrophobicity analysis of GDH mutants by ANS fluorescent probe. (A) Fitting curves for GDH mutants. The fluorescence intensity (λex 390 nm and λem 504 nm) of the GDH variants was analyzed and fitted linearly. (B) Hydrophobicity index of GDH mutants. The curve slope was used as an index of protein hydrophobicity . The results are expressed as the mean ± SD (n=3).
4. GDH和P45A的特性
在本研究中,我们分析了P45A的特性,因为它比其他突变体具有更好的催化能力。图5显示了GDH和P45A在不同pH和温度下的相对活性。根据图5A所示的数据,丙氨酸取代脯氨酸残基将最适温度从60℃提高到65℃。通过定点诱变,热稳定性没有显著变化。发现GDH和P45A在55℃下稳定,处理20分钟后剩余活性达到80%,如图5B所示。然而,在60℃下处理20分钟后,残余活性降低至30%,这表明葡萄糖脱氢酶的热稳定性需要进一步研究。通过测量60℃下的活性,确定纯化GDH和P45A的最佳pH,pH范围为3至12。我们发现,纯化的GDH和P45A的最佳pH值在pH 9时观察到(图5C),低于通常报道的来自Lysinibacillus sphaericus G10和B.amyloliquefaciens SB5的耐碱GluDH的pH 10.0。在pH 7.0-9.0时,残余酶活性超过80%,这优于芽孢杆菌属的其他GDH。然而,酶活性在pH值下显著降低≥10.0.这是因为由于位于亚基-亚基界面的酸性氨基酸的排斥,GDH四聚体在较高pH下解离成非活性单体。
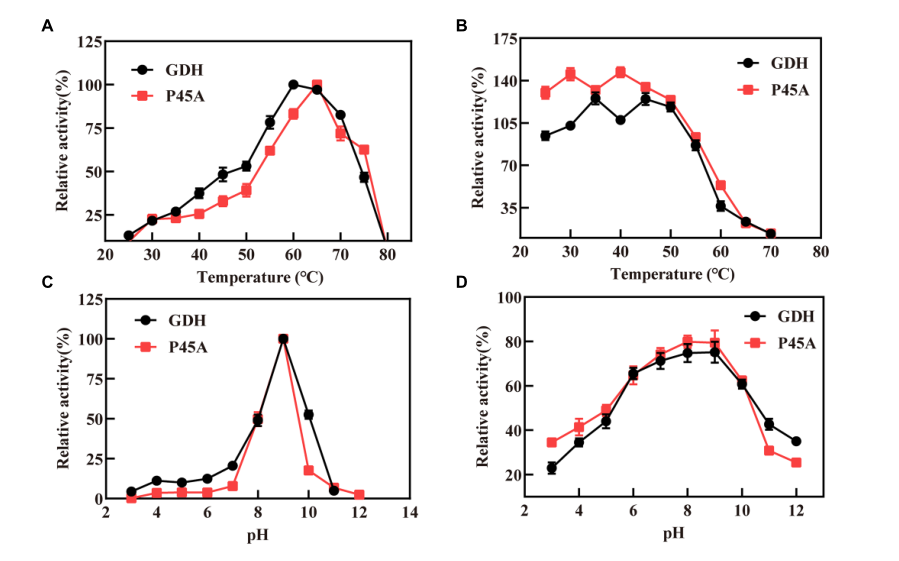
Figure 5 Characteristics of GDH and P45A. (A) Effect of different temperature values on the activity of GDH and P45A; (B) The residual activity of GDH and P45A after incubated at various temperatures for 20 min; (C) Effect of different pH values on the activity of GDH and P45A; (D) The residual activity of GDH and P45A after incubated at various pH values for 20 min. The results are expressed as the mean ± SD (n = 3).
5. 有机溶剂对GDH和P45A催化活性和稳定性的影响
在这项研究中,添加五种特定有机溶剂后,在缓冲系统中检测到酶活性(图6)。发现GDH和P45A在10%异丙醇溶剂中表现出最好的活性,分别达到36.61和691.6U/mg。根据获得的结果,P45A在有机溶剂中仍然显示出比野生型GDH更好的催化能力。然而,P45A的酶活性在异丙醇、甲醇和乙二醇溶液中10分钟后显著降低(图6B),这高于GDH(图6A)。P45A的水合层和盐桥可能比GDH更容易被破坏,这些是维持蛋白质结构的主要力量。另一方面,P45A的活性袋更容易被极性有机溶剂攻击,因为其较高的疏水性导致底物结合能力降低。随后,检测了两种酶的动力学常数和在有机溶剂中的半衰期,如表2所示。我们发现,P45A的最大反应速率(Vmax)、快速反应速率(Kcat)和Kcat/Km在所有五种有机溶剂中都远高于野生型GDH。此外,它在有机溶剂中的半衰期比野生型GDH更长。这表明P45A在有机溶剂中的稳定性也增强了,这可能是因为P45A的疏水性更高更有利于形成热力学驱动力。然而,与GDH(分别为18.47、12.62、15.43和16.42μM)相比,P45A对NADP(+)(异丙醇32.82μM、丙酮26.58μM、甲醇-238.5μM和DMSO 35.21μM)的Km值更高,表明其底物亲和力受到有机溶剂的影响。未来,我们将专注于提高GDH在有机溶剂中的底物亲和力。
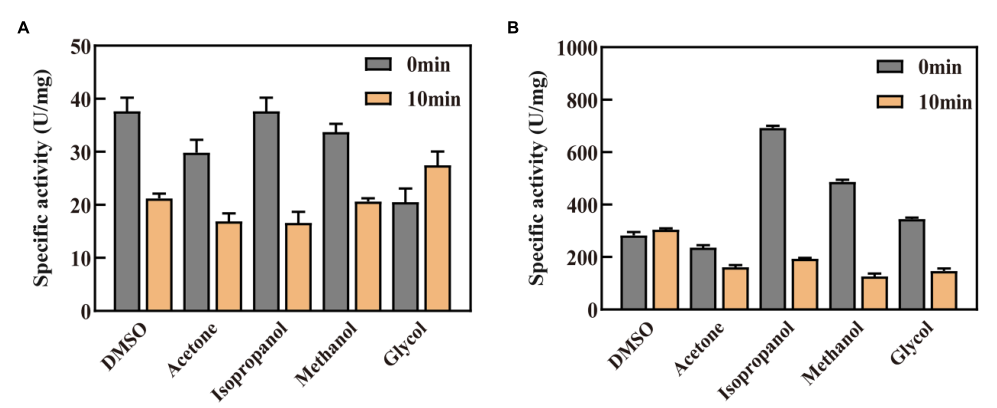
Figure 6 Effect of organic solvents on the catalytic activity and stability of GDH and P45A. (A) Effect of organic solvents on GDH. (B) Effect of organic solvents on P45A. A final concentration of 10% (V/V) organic solvent was added into the enzyme solution. The residual enzyme activity was detected when the enzyme was kept in the solution for 0 or 10 min. The results are expressed as the mean ± SD (n = 3).
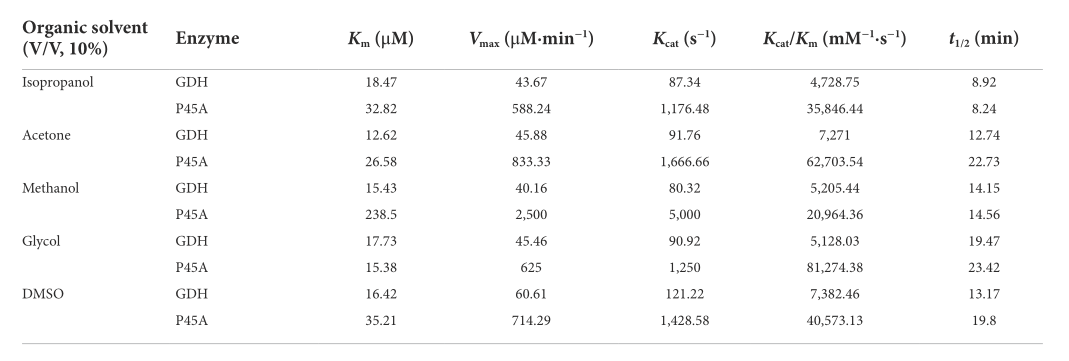
Table 2 Kinetic parameters of GDH and P45A in organic solvents
Conclusion
总之,我们通过定点诱变成功地获得了一个优秀的突变体P45A,并发现GDH的催化活性与其活性袋的疏水性呈正相关。GDH合成NADPH受到许多因素的限制,包括但不限于蛋白质-配体复合物中的氢键和生物催化剂的热稳定性。在本研究中,突变体P45A的酶活性显著提高了29倍,达到1829.03 U/mg。这是因为突变体P45A的底物NADP(+)亲和力和口袋疏水性显著增强。这是首次报道囊袋疏水性与GDH催化能力之间正相关的研究。同时,P45A在10%的有机溶剂中仍能发挥良好的催化能力。然而,有机溶剂显著影响其底物亲和力。因此,我们未来将专注于提高GDH在有机溶剂中的底物亲和力。我们的研究为进一步提高GDH的催化效率提供了良好的理论基础。